- Accueil
- LA BOTANIQUE
- LES MALADIES BACTÉRIENNES
- NOMENCLATURE DES BACTERIES
- Gluconobacter cerinus
Gluconobacter cerinus
Les phytopathogènes peuvent nouer des relations avec les hôtes insectes pour compléter leur cycle de vie et ils modifient souvent le comportement et le développement des hôtes pour améliorer leur condition physique. Afin de déterminer si certaines bactéries responsables de la pourriture des fruits pourraient avoir développé des interactions symbiotiques avec Bactrocera dorsalis, nous avons étudié le profil des bactéries symbiotes de la mouche. Nous avons identifié la bactérie souche CDF1 de Gluconobacter cerinus provenant des ovaires et des œufs de la mouche orientale B. dorsalis, et la quantité de souche CDF1 de Gluconobacter cerinus a augmenté de manière significative à mesure du développement des ovaires et des fruits sur lesquels des œufs non stériles ont été pondus. L’addition de la souche CDF1 de Gluconobacter cerinus aux bananes accélère le processus de pourriture et son addition aux œufs accélère leur vitesse de développement / éclosion. Globalement, nos données suggèrent que la souche CDF1 de Gluconobacter cerinus est bénéfique pour la mouche des fruits.
Introduction
Les insectes et les plantes coexistent depuis plus de 400 millions d'années (Sugio et al. 2014 ), et les interactions plante-insecte sont considérées comme l'un des systèmes les plus primitifs et les plus évolués (Bronstein et al. 2006 ). L'interaction entre les plantes et les insectes herbivores est considérée comme une course aux armements: alors que les insectes doivent faire face aux défenses des plantes et élaborer des stratégies pour les surmonter, les plantes ont tendance à réduire les herbivores par divers mécanismes (Bronstein et al. 2006 ; Sugio et al. 2014 ). Les plantes peuvent influencer le comportement, la croissance et la reproduction des insectes herbivores en modifiant les éléments nutritifs et les métabolites secondaires (Ali et Agrawal 2012 ; Mithöfer et Boland 2012 ; Dawkar et al. 2013 ). En réponse, les insectes sur les plantes peuvent alors s'adapter de différentes manières (Potting et al. 1995 ; Strauss et al. 2013 ). Par exemple, des études ont montré que les types de toxines produites par les plantes et les modes de réponse des insectes herbivores peuvent affecter les réponses adaptatives, ce qui peut entraîner une évolution convergente au niveau moléculaire (Susanne et al. 2012 ).
Les chercheurs ont découvert que les plantes et les insectes établissent différents types de relations avec des associés microbiens qui influent sur les résultats des interactions plante-insecte (Sugio et al. 2014 ). Les métabolites primaires et secondaires des plantes et / ou les défenses des plantes contre les insectes peuvent être modulés par les microbes, ce qui peut être bénéfique pour les insectes. De même, les microbes peuvent affecter la biologie des insectes, notamment en modifiant leur métabolisme et leur comportement. Par exemple, on a constaté que les rickettsies se propagent rapidement (6 ans) dans les populations naturelles de mouche blanche de la patate douce Bemisia tabaci dans le sud-ouest des États-Unis et augmentent considérablement les performances des mouches blanches infectées par rapport aux mouches blanches non infectées (Himler et al. 2011 ). De même, Enterobacter Erwinia sp., Qui infecte les thrips de Frankliniella occidentalis , peut être bénéfique pour ses hôtes en fonction de la plante sur laquelle les thrips se nourrissent (Vries et al. 2004 ). De nombreux micro-organismes associés aux insectes peuvent même favoriser la capacité des insectes à utiliser des régimes comportant un contenu nutritionnel faible ou déséquilibré en fournissant des nutriments spécifiques que l'insecte ne peut pas synthétiser, notamment des acides aminés essentiels, des vitamines B et des stérols (Douglas 2015 ). Par exemple, lorsque les bactéries Buchnera sont éliminées des pucerons à l'aide d'antibiotiques, elles perdent leur capacité à synthétiser des acides aminés essentiels (Febvay et al. 1999 ; Douglas et al. 2001 ). Les micro-organismes des insectes situés dans la chambre de fermentation de l'intestin postérieur interviennent dans la lente dégradation enzymatique des composants cellulosiques et hémicellulosiques des tissus végétaux en sucres, qui sont ensuite disponibles pour les insectes (Calderóncortés et al. 2012 ).
La mouche orientale des fruits Bactrocera dorsalis (Hendel) (Diptera: Tephritidae) est un ravageur notoire qui endommage une large gamme de fruits et autres produits horticoles (Hollingsworth et al. 2003 ; Yee et Goughnour 2008 ). Les dégâts causés par B. dorsalis peuvent provoquer la pourriture et la chute des fruits, entraînant des pertes économiques (Jiang et al. 2011 ). De nombreuses études ont montré que les bactéries symbiotiques d'insectes peuvent décomposer les tissus végétaux pour compléter les nutriments essentiels de leurs insectes hôtes (Douglas et al. 2006 ; Feldhaar 2011 ; Price et al. 2014 ). Nous avons donc émis l’hypothèse que certaines bactéries responsables de la pourriture des fruits pourraient avoir développé des interactions symbiotiques avec B. dorsalis. Cependant, les données complémentaires sur les communautés bactériennes - les données nécessaires pour évaluer efficacement l'hypothèse - n'ont pas été collectées. Ici, nous avons analysé simultanément les profils bactériens et développementaux de B. dorsalis et l'effet de pourriture chez les fruits afin de déterminer s'ils co-variaient.
Nos résultats démontrent que les communautés bactériennes de B. dorsalis sont dominées par certaines bactéries et que le développement de B. dorsalis et de la pourriture des fruits sont affectés par la bactérie Gluconobacter , qui peut provoquer une maladie rose des plantes (Kontaxis 1978 ; Rohrbach 1989 ). Cette étude suggère que la bactérie Gluconobacter chez B. dorsalis est suffisante pour augmenter la capacité d'adaptation de l'hôte. En outre, il fournit un nouvel exemple d'agent pathogène bactérien pouvant également servir de symbiote bénéfique pour les insectes.
Matériaux et méthodes
Insectes
Les B. dorsalis utilisés dans cette étude ont été initialement collectés en avril 2015 dans un verger de caramboles ( Averrhoa carambola ) à Guangzhou, province du Guangdong, et ont été élevés en laboratoire pendant 1 génération dans les conditions suivantes: 25 ± 1 ° C, 16: 8 h lumière: cycle d'obscurité, 70–80% HR, et régime alimentaire artificiel à base de maïs contenant 150 g de farine de maïs, 150 g de banane, 0,6 g de benzoate de sodium, 30 g de levure, 30 g de saccharose et 30 g d'essuie-tout, 1,2 mL d'acide chlorhydrique et 300 mL d'eau. Le régime alimentaire des adultes se composait d'eau, d'hydrolysat de levure et de sucre.
Adaptabilité de Bactrocera dorsalis et effet sur les fruits après traitement aux œufs par un antibiotique
Pour déterminer si les bactéries présentes dans B. dorsalis affectent l’adaptabilité des mouches et la pourriture des fruits, 30 œufs fraîchement pondus ont été trempés dans une solution de streptomycine (0,5 mg / mL) pendant 1 h. Afin de montrer l’effet de l’antibiotique sur les bactéries présentes dans les œufs, les bactéries présentes dans les œufs traités à la streptomycine (0,5 mg / mL) (5 œufs ont été broyés et dilués dans 1 mL d’eau stérile) ont été cultivées sur le milieu de culture Luria – Bertani, et les bactéries présentes dans les œufs normaux ont été cultivées comme témoins. Quatre répétitions ont été effectuées. Et les œufs traités aux antibiotiques ont été recueillis, immédiatement séchés avec du papier absorbant et inoculés dans des fruits fraîchement cueillis (goyave et mangue). Après l'inoculation, les états des fruits ont été enregistrés tous les 2 jours. Six jours après l'inoculation, le taux d'éclosion et le développement des larves ont été comparés. Trois répétitions ont été effectuées. Pour les témoins, trois réplicats avec des œufs imbibés d’eau ont également été réalisés.
Enquêtes sur les unités taxonomiques opérationnelles bactériennes (UTO)
Pour identifier l'effet potentiel des bactéries symbiotiques sur l'adaptabilité de B. dorsalis et la pourriture des fruits, les ovaires de 3 mouches femelles de la même population ont été disséqués et recueillis tous les 2 jours depuis leur émergence. Les mouches ont été trempées dans de l'alcool à 75% pendant 3 min pour éviter la contamination de l'environnement. Les mouches trempées ont été disséquées au stéréomicroscope dans de l'alcool à 75% et les ovaires ont été lavés à l'alcool et transférés dans des tubes à centrifuger contenant un tampon d'extraction d'ADN. Une partie des échantillons de fruits de goyave pourris ont également été collectés tous les 2 jours après l'inoculation d'œufs de mouche. Les échantillons d'ADN ont été extraits à l'aide d'un kit d'extraction d'ADN (Tiangen, Beijing, Chine) en suivant les instructions du fabricant. Les gènes d'ARNr 16S bactériens ont été amplifiés à partir de l'ADN extrait par PCR, en utilisant deux amorces dégénérées largement conservées ciblant la région variable V3 + V4 du gène 16S (F: 5′-CCTACGGGGGGCGCGGC-3 'et R: 5′-GGACTACHVGGTATCTAAT-3 ′). Chaque échantillon a été analysé dans un volume réactionnel total de 25 µL contenant 2,5 µL de tampon Takara 10 × Ex Taq, 1,5 µL de Mg 2+ (25 mM), 2 µL de dNTPs (2,5 mM), 0,25 µL de Takara Ex Taq (2,5 U / µL), 0,5 µL de chaque amorce (10 µM), 16,75 µL de ddH 2 O et 1 µL de matrice. Les amplifications PCR ont été réalisées avec une incubation de 2 minutes à 95 ° C suivie de 30 cycles à 94 ° C pendant 30 secondes, à 57 ° C pendant 30 secondes et à 72 ° C pendant 30 secondes, avec une extension finale de 5 minutes à 72 ° C. Les produits de PCR ont été purifiés à l'aide d'un kit de purification QIAGEN MinElute PCR afin d'éliminer les amorces et les nucléotides non incorporés. Un microspectrophotomètre ND-1000 (NanoDrop Technologies, Wilmington, DE, USA) a été utilisé pour mesurer la concentration de l'ADN purifié. Des adaptateurs ont été ajoutés à l'ADN purifié pour constituer une bibliothèque de séquençage à l'aide d'un kit de séquençage Illumina et d'un séquenceur Illumina MiSeq (Illumina, San Diego, Californie, États-Unis). Après séquençage, les données ont été filtrées pour éliminer les séquences de faible complexité (telles que les séquences poly (A)) et les séquences avec Ns. Les séquences filtrées ont été appelées séquences cibles (étiquettes). Pour obtenir des étiquettes uniques et déterminer le nombre d'étiquettes dans l'ensemble de données, l'ensemble de données a été soumis à un traitement de redondance à l'aide du logiciel Mothur (version 1.27.0) (Schloss et al. 2009 ). Pour l'annotation taxonomique, un classifieur RDP (Huse et al. 2010 ) a été utilisé avec des paramètres naïfs de Bayes; le seuil de confiance a été fixé à 0,5. Pour obtenir des informations supplémentaires sur la diversité taxonomique, nous avons soumis les étiquettes à une analyse d'abondance OTU. Le nombre d'UTU a été calculé à l'aide du logiciel Mothur avec une similarité de 97% (Schloss et al. 2009 ). Nous avons d'abord annoté les balises dans une OTU. Ensuite, l'OTU a été annotée avec l'unité taxonomique. Les informations d'annotation des unités taxonomiques des UTO ont été utilisées pour générer des profils d'abondance des UTO pour tous les échantillons. Les profils d'abondance des UTO dans différents échantillons ont été utilisés pour effectuer des analyses de composants principaux et de regroupements afin d'étudier les différences entre les échantillons à l'aide du logiciel R. Pour assurer l'exactitude, les UTO avec une abondance inférieure à 0,001 dans tous les échantillons ont été supprimés.
Analyse de différence des échantillons basée sur le niveau de classification
Pour identifier les biomarqueurs entre les différents échantillons, l'analyse LEfSe a été réalisée à l'aide d'un logiciel en ligne (Segata et al. 2011 ). Pour l'analyse LEfSe, la valeur alpha pour le test factoriel de Kruskal-Wallis parmi les classes et la valeur alpha pour le test de Wilcoxon par paires entre les sous-classes ont été définies à 0,05. Enfin, le seuil du score logarithmique LDA pour les caractéristiques discriminantes a été défini à 4.0.
Isolement bactérien et culture
Les œufs de B. dorsalis nouvellement pondus ont été collectés et immédiatement immergés dans de l'éthanol à 70% pendant 1 min pour éliminer les bactéries de surface. Ensuite, les œufs ont été recueillis dans un tube à centrifuger stérile auquel ont été ajoutés 200 µL d’eau stérile. Les oeufs ont été broyés avec des pilons de broyage stériles et 20 µL de fluide ont été enduits et cultivés sur une plaque de milieu de culture (1% de glucose, 0,5% d'éthanol, 1,5% d'agar, 0,8% d'extrait de levure et 0,3% d'acide acétique). à 30 ° C. Les colonies de même morphologie ont été sélectionnées pour la sous-culture. Les cultures pures ont été inoculées dans un milieu liquide (1% de glucose, 0,5% d'éthanol, 0,8% d'extrait de levure et 0,3% d'acide acétique) et les cultures liquides ont été stockées dans une solution de glycérol à 25% à -80 ° C. Et le test de sensibilité de la bactérie isolée à la streptomycine (0,5 mg / mL) a été effectué.
Amplification et identification de l'ARNr 16S
Les bactéries ont été recueillies dans des cultures pures pour l'extraction de l'ADN génomique à l'aide d'un kit d'extraction de l'ADN du génome bactérien (Tiangen, Beijing, Chine) conformément aux instructions du fabricant. L’amplification de l’ARNr 16S a été réalisée dans un volume réactionnel total de 50 µL avec 0,4 µL d’ADN polymérase (5 U / µL), 5 µL de tampon PCR 10 ×, 4 µL de dNTP (2,5 mM), 1 µL de chaque amorce ( 10 µM) (F: 5′-AGAGTTTCATCCTGGCTCAG-3 'et R: 5′-TACGGTTAXXTTGTTACGACTT-3'), 3 µL de matrice d’ADN et 33,6 µL de ddH 2 O. L’amplification PCR a été réalisée à l'aide d'un cycleur thermique d'Eppendorf et a été lancée avec une incubation de 5 minutes à 95 ° C suivie de 35 cycles à 95 ° C pendant 1 minute, à 55 ° C pendant 1 minute et à 72 ° C pendant 2 minutes, avec une extension finale à 72 ° C pendant 10 minutes. Les produits de PCR ont été confirmés par électrophorèse dans un gel d'agarose à 0,8% et purifiés avec un kit de purification de l'ADN sur gel (Tiangen, Beijing, Chine). L'ADN purifié a été ligaturé dans le vecteur T (Tiangen, Beijing, Chine) et transformé dans des cellules Top10 E. coli (Tiangen, Beijing, Chine) conformément aux instructions du fabricant. Les cellules transformées ont été réparties sur des plaques de gélose LB et, après sélection de l'antibiotique et coloration bleue / blanche, les colonies ont été sélectionnées pour la PCR de colonies et le séquençage direct. Les séquences ont été soumises à une recherche BLAST dans la base de données NCBI pour une analyse d'homologie de séquence.
Effet de la souche CDF1 de Gluconobacter cerinus sur le fruit
Pour tester l’effet de la souche CDF1 de Gluconobacter cerinus (numéro d’accession: KX578017 dans Genbank, GDMCC 1.1207), qui est maintenant déposée dans la collection de cultures accessible au public GDMCC (Centre de microbiologie de la culture de la culture du Guangdong, Chine) sur un fruit, 10 µL de la souche CDF1 de Gluconobacter cerinus inoculum ont été enduits sur une banane. Les fruits ont été incubés pendant 3 jours à 30 ° C et la pourriture de la banane a été enregistrée. Comme témoin, des bananes enrobées de milieu fluide stérile ont également été préparées et incubées pendant 3 jours à 30 ° C.
Adaptabilité des mouches et taux de pourriture des fruits après l'inoculation des œufs avec la souche CDF1 de Gluconobacter cerinus
L'inoculum de souche CDF1 de Gluconobacter cerinus a été préparé en sélectionnant et en incubant une colonie de souche CDF1 de Gluconobacter cerinus dans un milieu de culture (glucose à 1%, gélose à 1,5%, extrait de levure à 0,8%) à 30 ° C. Ensuite, les œufs de mouche nouvellement pondus ont été collectés et trempés dans l'inoculum de la souche CDF1 de Gluconobacter cerinus pendant 1 h. Par la suite, les œufs ont été placés dans le régime artificiel; chaque traitement a reçu 50 oeufs. Après 5 jours, le nombre et le poids des larves de mouches ont été enregistrés (5 répétitions). À titre de contrôle, des œufs de mouche fraîchement pondus trempés dans de l’eau pure ont également été préparés et placés dans le régime artificiel.
Analyses statistiques
Les différences entre les traitements et les contrôles ont été comparées par des tests t d'échantillons indépendants ou une analyse de variance unidirectionnelle (ANOVA) suivie par le test de Tukey pour des comparaisons multiples. Les différences ont été considérées comme significatives à p <0,05. Les données ont été analysées à l'aide du logiciel SPSS. Pour identifier des biomarqueurs entre différents échantillons, une analyse LEfSe (taille discriminante de l'effet linéaire) a été réalisée à l'aide d'un logiciel en ligne. Pour l'analyse LEfSe, la valeur alpha pour le test factoriel de Kruskal-Wallis parmi les classes et la valeur alpha pour le test de Wilcoxon par paires entre les sous-classes ont été définies à 0,05.
Résultats
Les profils bactériens des ovaires de mouches
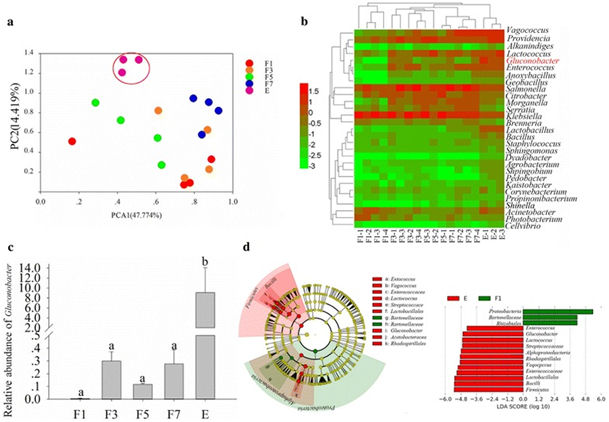
Pour identifier comment les mouches obtiennent des bactéries qui sont bénéfiques pour leur développement et peuvent causer la pourriture des fruits, nous avons étudié les profils bactériens des ovaires de mouche à différents stades de développement. Les enquêtes sur les gènes de l'ARNr 16S, utilisant une définition OTU de 97% de similarité de bases de nucléotides homologues, ont révélé que les communautés bactériennes des ovaires de mouches étaient très différentes à différents stades de développement. L'analyse en composantes principales des communautés bactériennes a également révélé que les communautés bactériennes dans les ovaires des mouches à différents stades de développement étaient très différentes (Fig. 1 a). Pour l'annotation d'espèce, l'abondance de Gluconobacter a augmenté de manière significative avec la maturation des ovaires (ANOVA: F = 4,251, df = 17, P = 0,02; Fig. 1 b, c). De plus, les résultats des analyses LEfSe ont indiqué que Gluconobacter augmentait de manière significative à mesure que l'ovaire devenait mature et constituait le facteur clé de différenciation des ovaires matures (Fig. 1d), ce qui pourrait indiquer que Gluconobacter est un facteur clé affectant le développement des glossines. De plus, les unités taxonomiques supérieures de Gluconobacter ont été identifiées comme les biomarqueurs dans les ovaires matures en raison de la quantité accrue de Gluconobacter.
Communautés bactériennes dans les ovaires des mouches. a Analyse en composantes principales des communautés bactériennes. b Cladogramme d'analyse en grappes montrant les bactéries identifiées. Les données ont été journalisées avant le traçage. c Différence d’abondance de Gluconobacter sp. d Le criblage de facteurs clés pour les différences entre les échantillons par analyse LEfSe, les biomarqueurs avec des scores LDA supérieurs à 4,0 ont été présentés en points verts ou rouges dans le cladogramme. Les moyennes (± SEM) étiquetées avec des lettres différentes sont significativement différentes. F1: ovaire d'une mouche femelle un jour après l'émergence; F3: ovaire d'une mouche femelle 3 jours après l'émergence; F5: ovaire d'une mouche femelle 5 jours après l'émergence; F7: ovaire d'une mouche femelle 7 jours après l'émergence; E: ovaire d'une mouche femelle avec des oeufs développés.
Les profils bactériens des fruits inoculés avec des œufs de mouche
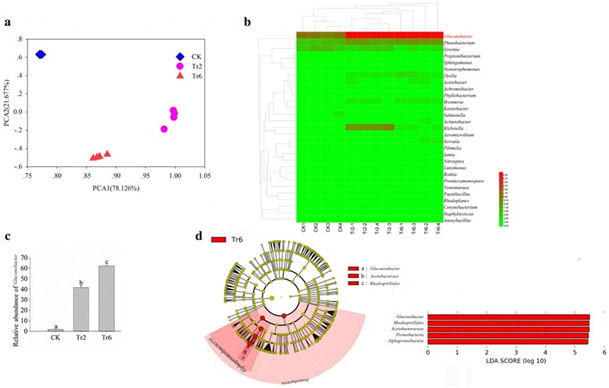
Afin de mieux identifier la fonction potentielle de Gluconobacter, les profils bactériens des fruits inoculés avec des œufs de mouche ont été étudiés à l'aide du séquençage de l'ARNr 16S. Nous avons constaté que les profils des communautés bactériennes dans les fruits de goyave inoculés avec des œufs de mouche étaient significativement différents, les larves éclosent et se nourrissant de fruits (Fig. 2 a). Lorsque les informations sur le genre ont été annotées dans les UTO, les profils d'abondance ont révélé que Gluconobacter présentait la plus grande différence lorsque les larves se nourrissaient dans la goyave. l'abondance de la bactérie était plus grande lorsque les mouches se développaient et que les fruits commençaient à pourrir (ANOVA: F = 777,392, df = 11, P <0,001; Fig. 2 b, c). De plus, les analyses de LEfSe ont indiqué que la quantité de Gluconobacter augmentait de manière significative à mesure que le fruit pourrissait était le facteur clé qui différenciait le goyave nourri par les larves pendant différentes durées (Fig. 2 d) et que les unités taxonomiques supérieures de Gluconobacter étaient également identifiées comme les biomarqueurs. dans la pourriture des fruits en raison de la quantité accrue de Gluconobacter. Ces résultats peuvent indiquer que les communautés bactériennes de Gluconobacter peuvent causer la pourriture chez la goyave et ont été bénéfiques pour le développement des mouches.
Les communautés bactériennes de goyave inoculées avec des œufs de mouche a Analyse en composantes principales des communautés bactériennes. b Cladogramme d'analyse en grappes montrant les bactéries identifiées. Les données ont été journalisées avant le traçage. c Différence d’abondance de Gluconobacter sp. d Le criblage de facteurs clés pour les différences entre les échantillons par analyse LEfSe, les biomarqueurs avec des scores LDA supérieurs à 4,0 ont été présentés en points verts ou rouges dans le cladogramme. Les moyennes (± SEM) étiquetées avec des lettres différentes sont significativement différentes. CK: échantillon de fruit de goyave prélevé un jour après l'inoculation d'œufs de mouche; Tr2: échantillon de fruit de goyave recueilli 2 jours après l'inoculation d'œufs de mouche; Tr6: échantillon de fruit de goyave prélevé 6 jours après l'inoculation d'œufs de mouche.
Gluconobacter sp. isolement et identification
Pour révéler la fonction de Gluconobacter sp., Une sous-culture a été réalisée sur des plaques plates d'agar spécifiques. Ensuite, les bactéries ont été identifiées par séquençage de l'ARNr 16S. Après 48 h, Gluconobacter sp. les colonies issues d'isolats d'œufs de mouche ont été identifiées par leur couleur blanche, leur centre surélevé, leur marge nette et leur surface lisse et humide (figure 3a). L'amplification et le séquençage de l'ARNr 16S suivants ont donné un fragment de 1377 pb (numéro d'accession Genbank: KX578017 ). D'après une recherche BLAST contre GenBank, la séquence d'ARNr 16S présentait une correspondance d'identité à 99% avec la souche PFR2 de Gluconobacter cerinus ; nous avons nommé la souche CDF1 de Gluconobacter cerinus (Fig. 3b).
Gluconobacter sp. isolement et identification. Caractéristiques des colonies sur des géloses pour une bactérie isolée des ovaires et des œufs de mouches. b Relations phylogénétiques de la souche CDF1 de Gluconobacter cerinus symbiotique. Le point rouge indique la souche CDF1 de Gluconobacter cerinus. Une phylogénie du maximum de vraisemblance déduite de 1377 sites nucléotidiques alignés dans des séquences de gènes d’ADNr 16S est présentée avec les valeurs de bootstrap.
Les antibiotiques modifient l’adaptabilité des mouches des fruits et le taux de pourriture des fruits
Pour manipuler le statut d'infection par le symbiote, les œufs de B. dorsalis ont été stérilisés en surface par trempage dans une solution de streptomycine. Les résultats ont montré que l'antibiotique avait diminué de manière significative le nombre de colonies de la souche CDF1 de Gluconobacter cerinus cultivées sur le milieu de culture LB (échantillons t indépendants, test t , t = 14,01, df = 6, p <0,001, Fig. 4 ). Et la procédure entraînait systématiquement une pourriture plus lente de la goyave et de la mangue (Fig. 5 a, c), davantage de taches noires sur la goyave et une zone plus étendue de pourriture sur la mangue sur le fruit sans traitement antibiotique (en goyave: échantillons indépendants, test t, t = 9,899, df = 4, p = 0,001; à la mangue: test t pour échantillons indépendants, t = 8,286, df = 4, p = 0,001, fig. 5 b, d). De plus, le développement de B. dorsalis était significativement affecté; sous goyave et mangue, le traitement antibiotique a entraîné un ralentissement du développement larvaire (Fig. 5 e, g) et du taux d'éclosion (en goyave: échantillons t-test indépendants, t = 6,25, df = 4, P = 0,003, Fig. 5 f ; à la mangue: échantillons t-test indépendants, t = 6,645, df = 4, P = 0,003, Fig. 5 h). Ces résultats peuvent indiquer que les bactéries symbiotiques dans les œufs sont importantes pour le développement des mouches et intensifient la pourriture des fruits.
Nombre de colonies de souche CDF1 de Gluconobacter cerinus cultivées séparées des oeufs traités avec un antibiotique. ** p <0,01
Effets sur les fruits, le développement des larves et l'éclosion après le traitement aux œufs de mouche par un antibiotique. a Effets sur la goyave après l'inoculation des œufs traités aux antibiotiques. b Nombre de taches noires sur la goyave inoculées avec des œufs. c Effets sur la mangue après l'inoculation des œufs traités aux antibiotiques. d Diamètre de la pourriture de mangue inoculé avec des œufs. e Longueur du corps des larves en éclosion chez la goyave. f Taux d'éclosion des œufs en goyave. g La longueur du corps des larves qui éclosent dans la mangue. h Taux d'éclosion des œufs dans la mangue. ** p <0,01
Gluconobacter sp. La souche CDF1 ralentit le développement des fruits en décomposition et des mouches des fruits
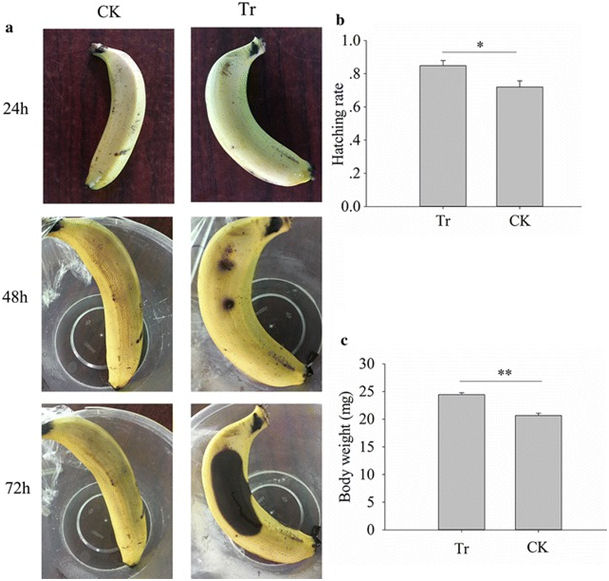
L'ajout d'inoculum de souche CDF1 de Gluconobacter cerinus aux bananes a provoqué l'apparition de la pourriture rapide (Fig. 6 a). De plus, le taux d'éclosion et le développement des mouches ont été améliorés par trempage des œufs de mouche dans l'inoculum de la souche CDF1 de Gluconobacter cerinus (test t de l'échantillon indépendant, t = 2,622, df = 8, P = 0,031, Fig. 6 b; t = 6,916, df = 38, p <0,001, figure 6 c). Ces résultats ont confirmé la fonction de Gluconobacter sp. souche CDF1 pour favoriser le développement des mouches et la pourriture des fruits.
Effets de la souche CDF1 de Gluconobacter cerinus sur le développement des bananes et des mouches. Un effet de Gluconobacter sp. sur la banane. b Effet de la souche CDF1 de Gluconobacter cerinus sur le taux d'éclosion des mouches. c Effet de la souche CDF1 de Gluconobacter cerinus sur le poids des larves. Tr: oeufs de banane ou de mouche peints avec la souche CDF1 de Gluconobacter cerinus ; CK: oeufs de banane ou de mouche peints avec de l'eau stérile. * p <0,05; ** p <0,01
Discussion
Notre étude a testé une association hôte-symbiote typique entre la souche CDF1 de Gluconobacter cerinus, agent phytopathogène, et son hôte, B. dorsalis. Nous avons démontré que (i) le traitement antibiotique inhibait le taux d'éclosion des mouches et la croissance des mouches et le taux de pourriture des fruits, et (ii) la bactérie Gluconobacter pouvait affecter le taux d'éclosion, la croissance des mouches et le taux de pourriture des fruits. Nos résultats ont démontré un mécanisme par lequel un phytopathogène et un insecte hôte éprouvent une relation symbiotique bénéfique.
Contrairement aux mammifères, les insectes tels que Drosophila ne contiennent en moyenne pas plus de 30 taxons différenciés ou OTU basés sur les séquences (Chandler et al. 2011 ; Colman et al. 2012 ; Jones et al. 2013 ). Les protéobactéries et, en particulier, les Enterobacteriaceae ont été identifiées comme les associations microbiennes les plus répandues parmi de nombreux insectes (Moran et al. 2008 ). De plus, Drosophila , un diptère apparenté, est également dominée par une bactérie à l'acide acétique (Chandler et al. 2011 ). La souche CDF1 de Gluconobacter cerinus identifiée appartient à Acetobacteraceae dans notre étude qui corrobore la conclusion chez Drosophila. Les communautés bactériennes situées dans différentes parties de l'hôte ont des fonctions différentes. De nombreuses bactéries hébergées dans les intestins des insectes jouent un rôle nutritionnel important qui affecte leur développement, directement ou indirectement (Dillon et Dillon, 2004 ), tandis que d’autres bactéries infectant les organes de reproduction des insectes peuvent altérer la survie de l’hôte (Engelstädter et Hurst 2009 ). Ainsi, la fonction de la souche CDF1 de Gluconobacter cerinus dans B. dorsalis corrobore cette conclusion.
Les insectes ont établi différents types de relations avec des associés microbiens qui influencent les résultats des interactions entre insectes (Sugio et al. 2014 ). Les microbes peuvent modifier la biologie de leurs insectes hôtes, y compris leur métabolisme et leur comportement. Les rickettsies , un symbiote d'insectes, manipulent la reproduction des insectes hôtes, augmentant considérablement les performances des aleurodes infectées par rapport aux aleurodes non infectées (Himler et al. 2011 ). Les bactéries peuvent fournir une quantité accrue de protéines pour nourrir les insectes; des niveaux plus élevés de pourriture peuvent faciliter l'alimentation avec moins d'enzymes hôtes nécessaires pour décomposer les cellules, ou permettent aux larves de se disperser davantage et de ne pas autant concurrencer les autres larves, ou de sucre dans les fruits peut être quelque peu toxique et les bactéries consomment un effet d’assouplissement du sucre sur les larves (Huang et Douglas 2015 ). Dans nos recherches, nous avons constaté que la souche CDF1 de Gluconobacter cerinus, un phytopathogène, améliorait l’aptitude des mouches des fruits et avait des effets négatifs sur les fruits; nous avons donc besoin de plus de preuves pour élucider le mécanisme en cause.
Les microbes peuvent manipuler les plantes pour attirer les insectes vecteurs (Jordano 2012 ). En faisant fermenter ou en endommageant des esters de fruits, des alcools, des acides ou du dioxyde de carbone, ces substrats de fermentation sont utilisés non seulement comme ressource alimentaire, mais également comme site de reproduction et attirent ainsi la drosophile (Hamby et Becher 2016 ). Chez le coléoptère, une étude a révélé que les communautés microbiennes enrichies en gènes impliqués dans les terpénoïdes (synthétisés par le pin et toxiques pour le coléoptère) sont fortement associées à Dendroctonus ponderosae (Adams et al. 2013 ). Et il a été démontré que les bactéries associées à D. ponderosae métabolisent les monoterpènes et les acides diterpènes (Boone et al. 2013 ). Certains microbes peuvent non seulement supprimer les systèmes de défense des plantes, mais également modifier l'architecture et / ou la physiologie des plantes pour attirer les insectes (Sugio et al. 2014 ). Grâce à une série de mécanismes d'action complexes, le phytoplasme de la jaunisse jaune peut modifier la physiologie de sa plante hôte, ce qui le rend plus attrayant pour la ponte par le vecteur de la cicadelle, M. quadrilineatus (Bai et al. 2009 ; Sugio et al. 2011 ; Maclean et al. 2011) . 2014 ). La composition volatile des plantes peut même être modifiée par certains microbes et attirer ainsi les insectes. La composition volatile de pomme est modifiée par une souche de phytoplasme, Ca. P. mali, pour attirer Cacopsylla picta (Mayer et al. 2008 ), et une infection par Liberibacter peut induire la libération de salicylate de méthyle pour attirer D. citri (Mann et al. 2012 ). Cependant, les mécanismes par lesquels les microbes modifient les substances volatiles des plantes n’ont pas été complètement décrits. Par conséquent, davantage de preuves sont nécessaires pour prouver si la souche CDF1 de Gluconobacter cerinus peut modifier la physiologie ou la volatilité des fruits pour attirer les mouches.
Date de dernière mise à jour : 02/11/2023
Ajouter un commentaire