Alternaria brassicicola
Alternaria brassicicola est un pathogène fongique nécrotrophique qui provoque la maladie des points noirs sur un large éventail d'hôtes, en particulier dans le genre de Brassica , y compris un certain nombre de cultures économiquement importantes telles que le chou, le chou chinois, le chou-fleur, les graines oléagineuses, le brocoli et le canola. Bien qu'il soit principalement connu comme un pathogène végétal important, il contribue également à diverses affections allergiques respiratoires telles que l'asthme et la rhinoconjonctivite .Malgré la présence de gènes d'accouplement, aucun stade de reproduction sexuelle n'a été signalé pour ce champignon. En termes de géographie, il est le plus susceptible de se trouver dans les régions tropicales et subtropicales, mais aussi dans des endroits à forte pluie et humidité comme la Pologne . Il a également été trouvé à Taiwan et en Israël . Son principal mode de propagation est végétatif. Les conidies résultantes résident dans le sol, l'air et l'eau. Ces spores sont extrêmement résistantes et peuvent passer l'hiver sur les débris des cultures et les plantes herbacées hivernantes.
|
Alternaria brassicicola
|
|
|
|
Classification scientifique
|
|
Royaume:
|
Champignons
|
|
Division:
|
Ascomycota
|
|
Classe:
|
Dothideomycetes
|
|
Commande:
|
Pléosporales
|
|
Famille:
|
Pleosporaceae
|
|
Genre:
|
Alternaria
|
|
Espèce:
|
A. brassicicola
|
|
Nom binomial
|
|
Alternaria brassicicola
(Schwein.) Wiltshire, (1947)
|
|
Synonymes
|
|
Alternaria brassicae f. microspora
Alternaria brassicae var. mineur
Alternaria circinans Berk. & MA Curtis, (1924)
Alternaria oleracea Milbraith, (1922)
Helminthosporium brassicae Henn, (1902)
Helminthosporium brassicicola Schwein, (1832)
Macrosporium cheiranthi var. circinans Berk. & MA Curtis , (1875)
Macrosporium circinans
Macrosporium commune var. circinans
Polydesmus exitiosus f. alternarioides JG Kühn, (1855)
Polydesmus exitiosus f. luxuriosum
Sporidesmium exitiosum f. alternarioides
Sporidesmium exitiosum f. luxuriosum
Sporidesmium septorioides
|
Croissance et morphologie
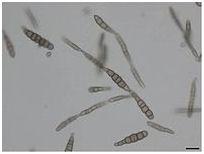

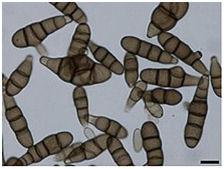
Conidies en forme de chaîne d’Alternaria brassicicola (gauche et droite)


Légions d’A. Brassicicola sur chou chinois
Les conidies d’A. Brassicicola sont abondantes dans l'environnement extérieur des mois de mai à fin octobre dans l'hémisphère nord, avec un pic en juin puis en octobre. Les conidies sont brun foncé et à parois lisses, jusqu'à 60 x 14µm. Les conidies sont de forme cylindrique à oblongue et sont muriformes et produites en chaînes de 8-10 spores. Ils sont fermement attachés à des conidiophores qui sont brun olive, cloisonnés et poussant jusqu'à une plage supérieure de 100-200 µm, bien que cette longueur totale puisse varier. Les conidies sont portées dans une structure continue en forme de chaîne, mais une ramification à la base a également été observée. Bien que les conidies puissent se propager par la pluie, le moyen de propagation le plus courant est l'air. Le champignon se développe sur la cire épidermique des feuilles des plantes, en particulier celles des Brassicacées , et préfère un environnement avec une humidité élevée et une plage de températures de 20 à 30 ° C (68 à 86 ° F). Macroscopiquement, le mycélium présente une gamme de couleurs: non pigmenté à l'état jeune, à gris olive, gris noir à maturité. Les colonies d'A. Brassicicola ont tendance à être de couleur brun foncé ou noire.
Historique de la recherche
Historiquement, une grande partie des premières recherches concernant le champignon était basé sur les mécanismes de défense des plantes. Cependant, une fois son génome séquencé, les efforts se sont tournés vers l'identification des gènes impliqués dans l'interaction hôte-parasite. L'un des pionniers de la recherche génétique sur Alternaria brassicicola était le groupe Lawrence du Virginia Bioinformatics Institute et du Génome Center de l'Université de Washington. Les milieux les plus couramment utilisés pour la croissance d' A. Brassicicola sont le PDA ( gélose dextrose de pomme de terre ) et le jus d'agar V8 . In vitro et dans des conditions optimales, les colonies se développent rapidement et apparaissent vert foncé ou blanc-gris. La sporulation spontanée se produit à 25 ° C dans l'obscurité sur un milieu PDA.
Cycle de croissance
Heures après l'inoculation:
- 2h: Les conidies gonflent
- 3h: Formation d'un tube germinal observée au niveau des cellules apicales ou moyennes des conidies
- 8h: La vésicule du contenu dissous passe de la cellule conidienne au tube germinatif
- 20h: Infection de la cellule hôte
- 48h: Le réseau mycélial se développe en surface
- 72h: De nombreuses chaînes de conidies sont visibles
Pathogenèse et infection
Il existe trois principales sources d'infection: les graines infectées à proximité, les spores de débris végétaux dans la couche arable et les mauvaises herbes Brassica, et les spores déplacées par le vent et l'air de plus loin. Les feuilles infectées peuvent propager leurs spores jusqu'à un diamètre de 1800 m. Il existe également trois principaux points d'entrée dans la cellule hôte: la pénétration épidermique , la pénétration stomatique et la pénétration par un insecte. Le contact avec la cellule hôte déclenche la libération de diverses enzymes dégradant la paroi cellulaire qui permettent au champignon de se fixer à la plante et de commencer la dégradation. Le mode d'attaque suggéré consiste à utiliser des toxines spécifiques à l'hôte, principalement des toxines AB , qui provoquent la mort cellulaire par apoptose . Il en résulte ce qui ressemble à des bosses et des lésions dans la plante hôte. Il s'agit de cercles concentriques bruns avec une teinte jaune à la circonférence, généralement d'environ 0,5 à 2,5 cm de diamètre. Nécrose peut généralement être observée dans les 48 heures suivant l'infection. Les spores peuvent résider sur le tégument externe des graines infectées, mais le mycélium peut également pénétrer sous le tégument, où il a la capacité de rester viable pendant plusieurs années. Parfois, il peut même pénétrer le tissu embryonnaire . Le principal mode de transmission est la semence contaminée. De plus, l'infection n'est pas limitée à des zones spécifiques de la plante hôte; il peut se répandre partout et même provoquer une fonte des semis à un stade relativement précoce. Il affecte également les espèces hôtes à différents stades de développement. Comme mentionné ci-dessus, les semis présentent des lésions de tige sombres suivies d'une fonte des semis. Des taches noires veloutées, ressemblant à de la suie, peuvent être observées sur les plantes plus âgées. La pathogenèse est affectée par des facteurs tels que: la température, l'humidité, le pH, les espèces d'oxydation réactive, les molécules de défense de l'hôte.

Colonies d’A. Brassicicola sur gélose dextrose de pomme de terre après 3 j (l) et 7 j (r).
Gènes
Sur les 10688 gènes prévus du génome d' A. Brassicicola , 139 codent pour de petites protéines de sécrétion qui peuvent être impliquées dans la pathogenèse, 76 codent pour des lipases et 249 codent pour des glycosyl hydrolases qui sont importantes pour la digestion des polysaccharides , endommageant potentiellement les cellules hôtes. En revanche, des mutations dans des gènes tels qu’AbHog1, AbNPS2 et AbSlt2 affectent l'intégrité de la paroi cellulaire et rendent le champignon plus sensible aux défenses de l'hôte. Actuellement, des recherches sont en cours pour identifier le ou les gènes responsables du codage d'un facteur de transcription, Bdtf1, important pour la détoxification des métabolites de l'hôte.
Biochimie
La toxine la plus couramment étudiée pour A. brassicicola est la toxine AB, qui serait liée à la virulence , à la pathogénicité et à la gamme d'hôtes du champignon. Il est très probablement produit pendant la germination des conidies et probablement lié à la capacité du champignon à infecter et coloniser les feuilles de Brassica. Cependant, des études récentes ont exploré de nouveaux métabolites potentiels. Par exemple, ce champignon produit également des inhibiteurs d'histone désacétylase , mais ceux-ci n'ont pas d'impact significatif sur la taille des lésions. Certaines études ne montrent qu'une réduction de 10% de la virulence. En outre, l' alternariol et l' acide tenuazonique semblent affecter respectivement les voies d'apoptose médiée par les mitochondries et la synthèse des protéines (dans la cellule hôte), mais encore une fois, pas de manière significative. Certaines cytokines ont été associées à la décoloration associée à une infection à A. brassicicola. Les enzymes dégradant la paroi cellulaire comme les lipases et les cutinases sont également liées à sa pathogénicité, mais davantage de preuves de leur efficacité sont nécessaires. Un facteur de transcription important est AbPf2. Il régule 6 des 139 gènes codant pour les petites protéines de sécrétion et peut avoir un rôle dans la pathogenèse, en particulier la digestion de la cellulose.
Traitements
Afin de protéger leurs cultures, de nombreuses personnes prétraitent leurs semences avec des fongicides . Les ingrédients actifs les plus répandus dans ces fongicides sont l' iprodione et les strobilurines . En 1995, il a été rapporté que l'iprodione agit très probablement en mutant deux résidus histidine dans le site cible des enzymes. En fin de compte, il inhibe la croissance du tube germinatif. Cependant, l'utilisation omniprésente de fongicides a fait en sorte que le champignon devient de plus en plus résistant. Ainsi, différentes approches non chimiques ont été explorées. Les gens ont essayé de développer des cultures de Brassicaceae résistantes par sélection. Cependant, cela s'est révélé difficile en raison de la difficulté de transférer des gènes de type sauvage à des souches cultivées, entraînant des goulots d'étranglement génétiques . Elle est encore compliquée par la probabilité que la résistance semble être un trait polygénique . Certaines plantes de Brassica ont naturellement développé une résistance au pathogène. Une activité phénolase élevée, un taux élevé de sucre foliaire et des couches de cire plus épaisses réduisent la germination des spores d'origine hydrique. Il a été démontré que la présence de camalexine dans la plante hôte l'aide à perturber le développement des agents pathogènes. Par exemple, un mutant d'Arabidopsis dans le gène pad-3 qui ne produit pas de camalexine est plus sensible à l'infection. Des niveaux variables montrent des niveaux de résistance différents. [3] Une autre suggestion avancée est la gestion des débris des cultures. L'objectif est de minimiser l'exposition des plantes cultivées aux spores présentes dans le sol en utilisant la rotation des cultures et le contrôle des mauvaises herbes.
Des approches biologiques ont également été étudiées. Une approche a consisté à utiliser des champignons antagonistes tels que Aureobasidium pullulans et Epicoccum nigrum pour atténuer l'effet d' A . Brassicicola. Les plantes C. fenestratum et Piper betle montrent également une puissante activité fongicide envers A. brassicicola à la fois in vitro et en serre. Ces niveaux sont comparables à l'iprodione. Le composé actif, la berbérine , affecte l'intégrité de la paroi cellulaire et la biosynthèse de l' ergostérol . Les extraits à l'éthanol des racines séchées de Solanum nigrum (morelle noire), traditionnellement utilisés comme remèdes à base de plantes dans des endroits allant de l'Extrême-Orient à l' Inde et au Mexique , montrent également une activité antifongique prometteuse. Ils semblent supprimer la germination des conidies, peut-être en interférant avec la toxine AB.
Impact économique
Comme mentionné précédemment, Alternaria brassicicola provoque de graves maladies des points noirs dans un certain nombre de cultures importantes sur le plan écologique. Souvent, il se produit en conjonction avec Alternaria brassicae . Cependant, c'est l'espèce envahissante la plus dominante. Ces infections entraînent une perte importante de semences et de produits viables. Les lésions qui en résultent réduisent considérablement la surface photosynthétique disponible, entraînant le flétrissement et la mort des plantes. Les cultures comme les choux infectés ne durent pas longtemps pendant le stockage ou le transport. Dans certains cas, les réductions de rendement peuvent atteindre 20 à 50%. Le manque de capacité à utiliser des fongicides rend difficile le maintien des cultures biologiques de manière rentable.
